05213 § 13 MPBetreibV: Medizinproduktebuch
|
§ 13 MPBetreibV legt fest, dass der Betreiber für bestimmte Produkte ein Medizinproduktebuch zu führen hat (nämlich für Produkte der Anlagen 1 und 2 MPBetreibV).
Im Medizinproduktebuch ist der Lebenslauf des aktiven Produkts und des medizinischen Messgeräts vom Zeitpunkt der Inbetriebnahme bis zur Außerbetriebnahme mit allen wesentlichen Ereignissen dokumentiert.
Der Beitrag bietet einen verständlichen Überblick über alle relevanten Aspekte dieses Paragrafs. Arbeitshilfen: von: |
§ 13 Medizinproduktebuch
(1) Für die in den Anlagen 1 und 2 aufgeführten Produkte hat der Betreiber ein Medizinproduktebuch nach Absatz 2 zu führen. Satz 1 gilt nicht für elektronische Fieberthermometer als Kompaktthermometer und Blutdruckmessgeräte mit Quecksilber- oder Aneroidmanometer zur nichtinvasiven Messung sowie in den Fällen des § 3 Absatz 4.
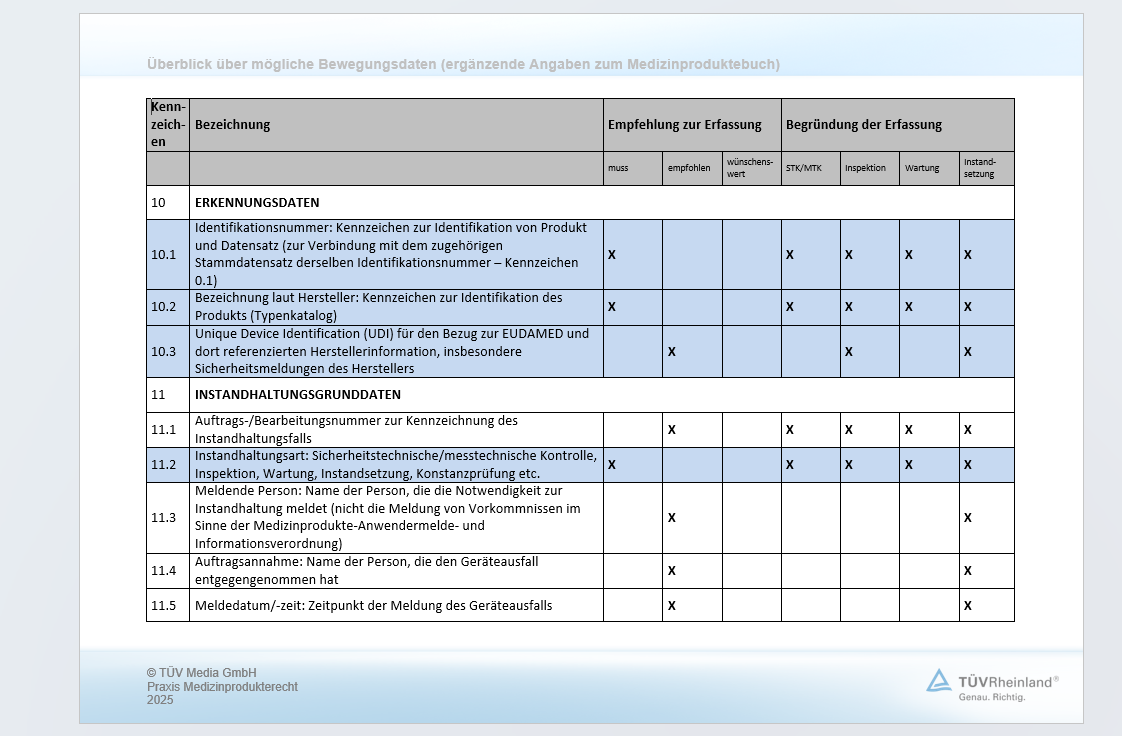
(2) In das Medizinproduktebuch, für das alle Datenträger zulässig sind, sind folgende Angaben zu dem jeweiligen Produkt einzutragen:
(3) Das Medizinproduktebuch ist so aufzubewahren, dass die Angaben dem Benutzer während der Arbeitszeit zugänglich sind. Nach der Außerbetriebnahme des Produktes ist das Medizinproduktebuch fünf Jahre aufzubewahren. |
1 Die wichtigsten Hinweise zu Paragraf 13 MPBetreibV
Die wichtigsten Hinweise zum Medizinproduktebuch sind hier zusammengefasst:
| • | Für alle Medizinprodukte, die den Anlagen 1 und 2 MPBetreibV zuzuordnen sind, muss der Betreiber ein Medizinproduktebuch führen. Dies gilt auch für medizinisch-technische Geräte, die der Gruppe 3 nach Medizingeräteverordnung zuzuordnen waren, nach den Regelungen der Medizinprodukte-Betreiberverordnung aber der Anlage 1 MPBetreibV zuzuordnen sind. |
| • | Die Form des Medizinproduktebuchs wird nicht konkret vorgegeben. Es besteht lediglich die Anforderung, dass die geforderten Angaben bis zum Ablauf der Aufbewahrungsfrist verfügbar sind. Der Betreiber kann somit beispielsweise nach wirtschaftlichen und organisatorischen Gesichtspunkten entscheiden, ob eine papiergebundene oder elektronische Form sinnvoller ist. |
| • | Die in § 13 Abs. 2 MPBetreibV geforderten Angaben sind verbindlich im Medizinproduktebuch aufzunehmen. Das unvollständige Führen eines Medizinproduktebuchs stellt eine Ordnungswidrigkeit dar. |
| • | Unter bestimmten Voraussetzungen kann in Verbindung mit den Angaben im Medizinproduktebuch eine weitergehende Instandhaltungsdokumentation sinnvoll sein. |
1.1 Änderungen zur Vorgängerversion
In der neuen Fassung der MPBetreibV vom 14. Februar 2025 wurde im Vergleich zur Vorgängerversion folgendes geändert:
| • | Neben denen von der Pflicht zur Führung eines Medizinproduktebuchs ausgenommenen elektronischen Fieberthermometer als Kompaktthermometer und Blutdruckmessgeräte mit Quecksilber- oder Aneroidmanometer zur nichtinvasiven Messung sind nun auch solche Produkte von dieser Pflicht befreit, die durch einen Versorgenden bereitgestellt werden und in das Eigentum des Patienten übergehen. Etwaige weiterführende Betreiberpflichten des Versorgenden, z. B. bezüglich der Betreiberpflichten zur Instandhaltung, bleiben jedoch davon unberührt. |
| • | Neu dazugekommen zu den Angaben, die im Medizinproduktebuch erfasst werden müssen, sind die Fristen, das Datum der Durchführung und das Ergebnis von IT-Sicherheitsüberprüfungen. |
1.2 Festlegungen
Im Einzelnen enthält § 13 MPBetreibV:
| • | die Verpflichtung zum Führen eines Medizinproduktebuchs für alle Produkte, die den Anlagen 1 und 2 MPBetreibV zuzuordnen sind; |
| • | die Feststellung, dass alle Datenträger für ein Medizinproduktebuch zulässig sind, wenn die Angaben bis zum Ablauf der Aufbewahrungsfrist verfügbar (lesbar) bleiben; |
| • | eine Ausnahmeregelung für bestimmte Fieberthermometer und Blutdruckmessgeräte zur nicht invasiven Blutdruckmessung sowie für Versorgende deren Medizinprodukte in das Patienteneigentum übergehen; |
| • | die Festlegung der Angaben, die im Medizinproduktebuch einzutragen sind. |
Anforderungen zur Aufbewahrung von Medizinproduktebüchern und zur Aufbewahrungsfrist nach Außerbetriebnahme eines Produkts sind in § 13 Abs. 3 MPBetreibV enthalten.
2 Was ist ein Medizinproduktebuch?
Im Medizinproduktebuch müssen bestimmte Angaben für solche Produkte festgehalten werden, die den Anlagen 1 und 2 MPBetreibV zuzuordnen sind. Die Angaben müssen während des gesamten Lebenszyklus des Produkts erfasst und aufbewahrt werden.
Diese vom Verordnungsgeber geforderte Dokumentation dient sowohl den Behörden als auch dem Betreiber zum Nachweis des ordnungsgemäßen Betriebs der Produkte der Anlagen 1 und 2 MPBetreibV.
Das Medizinproduktebuch im Sinne des Gesetzgebers muss kein Buch im klassischen Sinne sein. Es sind ausdrücklich alle Datenträger zulässig. Dies beinhaltet u. a., dass das Medizinproduktebuch für ein Produkt in thematisch unterschiedliche Teile unterteilt werden kann. Beispielsweise können
| • | die Stammdaten des Produkts zusammen mit den Daten zur messtechnischen/sicherheitstechnischen Kontrolle bzw. IT-Sicherheitsüberprüfung, zu Instandhaltungsmaßnahmen und zu Funktionsstörungen auf einem Datenträger A eingetragen und gepflegt werden, |
| • | die Einweisungsdaten zu diesem Produkt auf einem Datenträger B, |
| • | die Meldedaten von Vorkommnissen zu diesem Produkt auf einem Datenträger C. |
Sicherzustellen ist die Verknüpfung der Daten, die zu einem Produkt gehören. Die Wahl des jeweiligen Datenträgers steht dem Betreiber frei. Er muss gemäß Absatz 3 nur sicherstellen, dass das Medizinproduktebuch und somit die jeweils gewählten Datenträger während der Dauer der Aufbewahrungsfrist (fünf Jahre nach Außerbetriebnahme des Produkts) für Benutzer während der Arbeitszeit jederzeit zugänglich und lesbar sind.
Jedem Betreiber steht es frei, zusätzliche, nicht vom Gesetzgeber geforderte Daten mit der Datenbank des Medizinproduktebuchs zu verknüpfen.
3 Notwendigkeit zur Führung eines Medizinproduktebuchs
§ 13 Abs. 1 MPBetreibV legt unmissverständlich fest, dass ein Medizinproduktebuch ausschließlich zu führen ist für
| • | alle aktiven Produkte, die der Anlage 1 MPBetreibV zuzuordnen sind und |
| • | alle nicht aktiven und aktiven medizinischen Messgeräte, die der Anlage 2 MPBetreibV zuzuordnen sind. |
Hinweis
Einige medizinisch-technische Geräte der Gruppe 3 nach der alten Medizingeräteverordnung sind nach den Regelungen der Medizinprodukte-Betreiberverordnung der Anlage 1 MPBetreibV zuzuordnen, wie beispielsweise Ultraschallchirurgiegeräte, Röntgentherapiegeräte oder Beschleuniger für die Tumorbehandlung. Auch für diese Produkte, für die nach der Medizingeräteverordnung kein Gerätebuch zu führen war, ist ein Medizinproduktebuch zu führen.
Einige medizinisch-technische Geräte der Gruppe 3 nach der alten Medizingeräteverordnung sind nach den Regelungen der Medizinprodukte-Betreiberverordnung der Anlage 1 MPBetreibV zuzuordnen, wie beispielsweise Ultraschallchirurgiegeräte, Röntgentherapiegeräte oder Beschleuniger für die Tumorbehandlung. Auch für diese Produkte, für die nach der Medizingeräteverordnung kein Gerätebuch zu führen war, ist ein Medizinproduktebuch zu führen.
Empfehlung
Anästhesiegeräte ohne maschinelle Beatmung sind nicht der Anlage 1 MPBetreibV zuzuordnen. Beispielsweise ist folglich für Anästhesiegeräte mit ausschließlich manueller Beatmung, für Lachgas- Analgesiegeräte in der Zahnmedizin oder Lachgas-Narkosegeräte in der Gynäkologie kein Medizinproduktebuch zu führen. Empfohlen wird für diese Geräte, die der Gruppe 1 der Medizingeräteverordnung zugeordnet wurden und für die daher ein Gerätebuch zu führen war, trotzdem weiterhin ein Medizinproduktebuch zu führen.
Anästhesiegeräte ohne maschinelle Beatmung sind nicht der Anlage 1 MPBetreibV zuzuordnen. Beispielsweise ist folglich für Anästhesiegeräte mit ausschließlich manueller Beatmung, für Lachgas- Analgesiegeräte in der Zahnmedizin oder Lachgas-Narkosegeräte in der Gynäkologie kein Medizinproduktebuch zu führen. Empfohlen wird für diese Geräte, die der Gruppe 1 der Medizingeräteverordnung zugeordnet wurden und für die daher ein Gerätebuch zu führen war, trotzdem weiterhin ein Medizinproduktebuch zu führen.
4 Form des Medizinproduktebuchs
Die Form des Medizinproduktebuchs ist nach § 13 Abs. 2 MPBetreibV lediglich an folgende rechtlich vorgegebene Auflage gebunden:
„In das Medizinproduktebuch, für das alle Datenträger zulässig sind, sind folgende Angaben [...]"
Daraus folgt, dass ein Medizinproduktebuch nicht ein einzelnes Buch im eigentlichen Sinn des Worts sein muss. Der Verordnungsgeber lässt vielmehr alle denkbaren Datenträger zu, wenn die Angaben zunächst in der gesamten Betriebsphase vom Zeitpunkt der Inbetriebnahme bis zur Außerbetriebnahme verfügbar und lesbar sind, zuzüglich der in § 13 Abs. 3 MPBetreibV genannten Aufbewahrungsfrist nach der Außerbetriebnahme des Produkts von fünf Jahren.
Mit anderen Worten
Alle Formen wie beispielsweise Buch (Loseblattsammlung), Karteikarte oder elektronische Datenträger sind zulässig unter Beachtung der Verfügbarkeit (Lesbarkeit) der im Medizinproduktebuch eingetragenen Informationen.
Alle Formen wie beispielsweise Buch (Loseblattsammlung), Karteikarte oder elektronische Datenträger sind zulässig unter Beachtung der Verfügbarkeit (Lesbarkeit) der im Medizinproduktebuch eingetragenen Informationen.
Für welche Formen sich ein Betreiber nun entscheidet, ist primär von der beabsichtigten Nutzung des Medizinproduktebuchs abhängig.
Will ein Betreiber ausschließlich die Forderungen der Medizinprodukte-Betreiberverordnung erfüllen oder ist der Dokumentationsaufwand in Folge einer geringen Anzahl dokumentationspflichtiger Produkte überschaubar, bieten sich die Dokumentationsformen des Buchs oder der Karteikarte an. Dies könnte der Fall sein in Arztpraxen, Dialysezentren oder kleineren Krankenhäusern mit weniger als 100 Betten.
Es kann jedoch auch sein, dass Betreiber auch unter diesen Voraussetzungen – ausschließliche Erfüllung der reinen Dokumentationspflicht – aus Gründen einer leichteren Handhabbarkeit und Aufbewahrung eine rechnergestützte Dokumentationsform bevorzugen.
Wenn ein Betreiber über die reine Dokumentationspflicht des § 13 MPBetreibV hinausgehen möchte (z. B. aus Gründen einer systematischen Gerätebewirtschaftung), ist es sowohl aus organisatorischen als auch aus wirtschaftlichen Gründen sinnvoll, Datenverarbeitungssysteme zu nutzen. Nur so ist die Möglichkeit zur gezielten Auswertung aller gespeicherten Informationen wirtschaftlich gegeben. Es können alle Informationen – z. B. Störmeldungen, Fehlerursachen, Instandhaltungsberichte, Instandhaltungskosten, Ergebnisse von sicherheitstechnischen und messtechnischen Kontrollen und IT-Sicherheitsüberprüfungen – zentral gesammelt und ausgewertet werden.