02032 Artikel 32 MDR: Kurzbericht über Sicherheit und klinische Leistung
|
Artikel 32 der Verordnung (EU) 2017/745 definiert Regelungen und Anforderungen zur Erstellung des Kurzberichts über Sicherheit und klinische Leistung (engl. Summary of Safety and Clinical Performance, kurz: SSCP). Die MDCG-Leitlinie 2019-9 konkretisiert die Vorgaben der Verordnung für Hersteller und Benannte Stellen. Die Leitlinie steht Ihnen als Arbeitshilfe zur Verfügung (s. Haupttext).
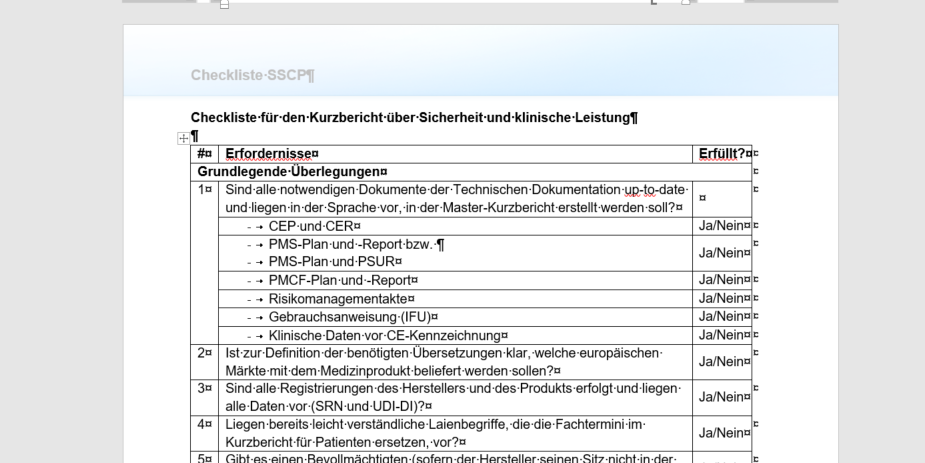
Ebenfalls als Arbeitshilfe angehängt ist eine Checkliste für die Erstellung des Kurzberichts. Arbeitshilfen: von: |
Artikel 32 MDR
Konsolidierte MDR-Version vom 24.04.2020 |
1 Einleitung
Mit der Verordnung (EU) 2017/745 (MDR) verfolgt die EU-Kommission die Ziele, das Medizinprodukterecht in der EU weiter zu vereinheitlichen, Medizinprodukte sicherer zu machen und Transparenz für Anwender und Patienten hinsichtlich der Medizinprodukte aller Risikoklassen und insbesondere der Hochrisiko-Medizinprodukte zu schaffen.
Der Erwägungsgrund 43 konkretisiert dieses Anliegen:
Erwägungsgrund 43
„Transparenz und angemessener Zugang zu Informationen, die für den vorgesehenen Anwender entsprechend aufbereitet sind, sind im öffentlichen Interesse unerlässlich, um die öffentliche Gesundheit zu schützen, die Rolle der Patienten und Angehörigen der Gesundheitsberufe zu stärken und ihnen sachkundige Entscheidungen zu ermöglichen, ein solides Fundament für gesetzgeberische Entscheidungen zu schaffen und Vertrauen in das Rechtssystem aufzubauen.” [Hervorhebung d. Autoren]
„Transparenz und angemessener Zugang zu Informationen, die für den vorgesehenen Anwender entsprechend aufbereitet sind, sind im öffentlichen Interesse unerlässlich, um die öffentliche Gesundheit zu schützen, die Rolle der Patienten und Angehörigen der Gesundheitsberufe zu stärken und ihnen sachkundige Entscheidungen zu ermöglichen, ein solides Fundament für gesetzgeberische Entscheidungen zu schaffen und Vertrauen in das Rechtssystem aufzubauen.” [Hervorhebung d. Autoren]