|
Die „MEDDEV-Leitlinien” sind Veröffentlichungen der Europäischen Kommission. Sie werden im Auftrag der Europäischen Kommission erarbeitet und dienen der Interpretation der
• EU-Richtlinie 90/385/EWG über aktive implantierbare medizinische Geräte,
• EU-Richtlinie 93/42/EWG über Medizinprodukte und
• EU-Richtlinie 98/79/EG über In-vitro-Diagnostika.
In den Arbeitshilfen finden Sie die aktuellen MEDDEV-Dokumente © European Union 1998-2020. Arbeitshilfen:
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.1/1: Definitionen von „Medizinprodukten", „Zubehör” und „Hersteller" vom April 1994.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.1/2 rev.2: Anwendungsbereich der Richtlinie über ”Aktive implantierbare Medizinprodukte" vom April 1994.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.1/2.1: Umgang mit Computern, die für die Programmierung von implantierbaren Pulsgeneratoren verwendet werden vom Februar 1998. In diesem Dokument wird eine Abgrenzung vorgenommen, wann kommerziell verfügbare Computer nicht als Medizinprodukte betrachtet werden müssen.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.1/3 rev.3: Borderline Produkte, Produkte, die Arzneimittel applizieren, und Medizinprodukte, die als integralen Bestandteil ein zusätzliches Arzneimittel oder ein Derivat aus menschlichem Blut enthalten. vom Dezember 2009. Dieses Dokument dient der Abgrenzung von Medizinprodukten gegenüber Arzneimitteln, um Hilfestellung bei der Interpretation der korrekten regulatorischen Anforderungen zu vermitteln.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.1/4: Verbindung mit anderen Richtlinien – Medizinprodukte/Richtlinie 89/336/EWG über die elektromagnetische Verträglichkeit und Richtlinie 89/686/EWG über die persönliche Schutzausrüstung vom März 1994.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.1/5: Medizinprodukte mit einer Messfunktion vom Juni 1998.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.1/6: Qualifikation und Klassifikation von eigenständiger Software vom Juli 2016.
In der Arbeitshilfe finden Sie das MEDDEV Dokument 2.2/1 rev.1: Anforderungen an die elektromagnetische Verträglichkeit (EMV) vom Februar 1998.
In der Arbeitshilfe finden Sie das MEDDEV 2.2/3 rev.3: ”Verwendbarkeitsdatum"-date vom Juni 1998.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.2/4: Konformitätsbewertung von Produkten zur In Vitro Fertilisation (IVF) und zu Technologien für die assistierte Reproduktion (ART) vom Januar 2012.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.4/1 rev.9: Klassifizierung von Medizinprodukten vom Juni 2010.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.5/3 rev.2: Qualitätssystem bezogene Vergabe von Unteraufträgen vom Juni 1998. In diesem Dokument werden Kriterien angegeben, wann Unterauftragnehmer durch die Benannten Stellen überprüft werden sollen.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.5/5 rev.3: Durchführung von Übersetzungen vom Februar 1998.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.5/6 rev.1: Homogene Chargen (Verifikation von Produkten eines Herstellers) vom Februar 1998.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.5/7 rev.1: Konformitätsbewertung von Brustimplantaten vom Juli 1998.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.5/9 rev.1: Bewertung von Medizinprodukten, die natürliches Latexgummi enthalten vom Februar 2004.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.5/10: Leitlinie für Bevollmächtigte vom Januar 2012.
In der Arbeitshilfe finden Sie das MEDDEV Dokument 2.7/1 rev. 4: Klinische Bewertung: Eine Leitlinie für Hersteller und Benannte Stellen vom Juni 2016.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.7/2 rev. 2: Leitlinien für zuständige Behörden zur Validierung/Bewertung von Anträgen auf klinische Prüfungen nach den Richtlinien 90/385/EWG und 93/42/EWG vom September 2015.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.7/3 rev. 3: Klinische Prüfungen: Meldung von schwerwiegenden unerwünschten Ereignissen (SAE) nach den Richtlinien 90/385/EWG und 93/42/EWG – SAE Meldeformular vom Mai 2015.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.7/4: Leitlinie zu klinischen Prüfungen: Eine Leitlinie für Hersteller und Benannte Stellen vom Dezember 2010.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.10/2 rev. 1: Benennung und Überwachung der Benannten Stellen im Rahmen der Europäischen Richtlinien für Medizinprodukte vom April 2001. (Hinweis: Die Anlagen 1-4 zu diesem Dokument finden sich auf der Website der EU Kommission und nachfolgend als eigenständige Dokumente).
In der Arbeitshilfe finden Sie den Anhang 1 zum MEDDEV-Dokument 2.10/2 rev.1: Guidance on the preparation of a curriculum vitae for a Medical Device Expert.
In der Arbeitshilfe finden Sie den Anhang 2 zum MEDDEV-Dokument 2.10/2 rev.1: Example of a training course format.
In der Arbeitshilfe finden Sie den Anhang 3 zum MEDDEV-Dokument 2.10/2 rev.1: The responsibilities of the Notified Body under the Medical Device Directives Document.
In der Arbeitshilfe finden Sie den Anhang 4 zum MEDDEV-Dokument 2.10/2 rev.1: Special Rules of accreditation for Certification Bodies of Quality Systems (scope ”Sterile Medical Devices").
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.12/1 rev. 8: Leitlinie für ein Medizinprodukte-Vigilanzsystem vom Januar 2013. (Hinweis: Seit Juni 2019 liegt ein Dokument „Zusätzliche Empfehlungen zur MEDDEV 2.12/1 rev. 8” vor, mit dem Definitionen präzisiert werden und in dem eine Reihe von Dokumenten und Formblättern erläutert werden, die in Ergänzung zur Leitlinie veröffentlicht wurden. Diese liegen ebenfalls als Arbeitshilfen vor).
In der Arbeitshilfe finden Sie Ausfüllhinweise zu den MIR- und FSCA-Formblättern
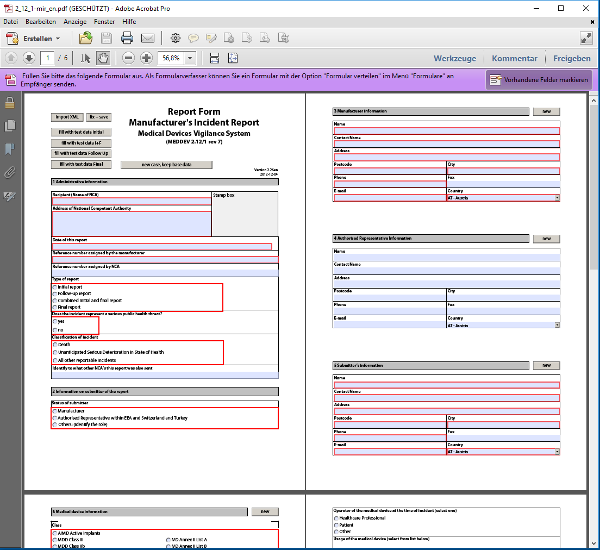
Dieses Formblatt vom Dezember 2012 war bis Ende 2019 für die Meldung von Vorkommnissen verpflichtend. Es wurde durch das „New MIR-form – as of January 2020” abgelöst (s.u.)
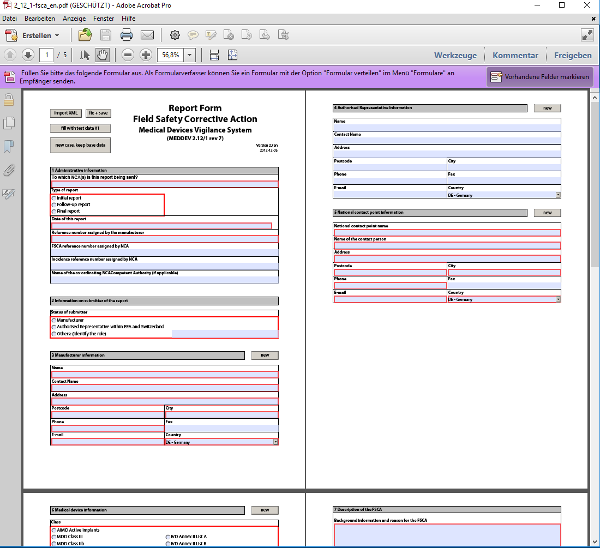
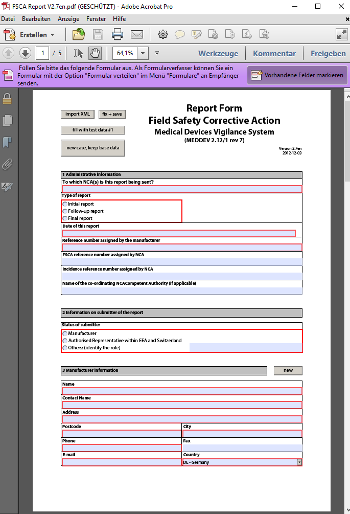
Dieses Formblatt vom Dezember 2012 ist weiterhin gültig und wird für die Meldung von Rückrufen und korrektiven Maßnahmen im Feld verwendet.
Durch Integration der MIR and FSCA xml files in die Vigilanzdatenbanken der Hersteller können die entsprechenden Meldungen erzeugt werden, ohne die o. g. Meldeformulare individuell auszufüllen.
Bei diesem Formblatt handelt es sich um eine Vorlage für die Erstellung einer dringenden Sicherheitsinformation in englischer Sprache im MS-Word-Format. Das Formblatt beinhaltet bereits Ausfüllhinweise, eine Liste von Fragen und Antworten zum Ausfüllen findet sich im ebenfalls bereitgestellten Dokument „Field Safety Notice Q&A”.
In der Arbeitshilfe finden Sie eine Liste von Fragen und Antworten zum Ausfüllen des ebenfalls bereitgestellten Dokuments „Field safety notice template”.
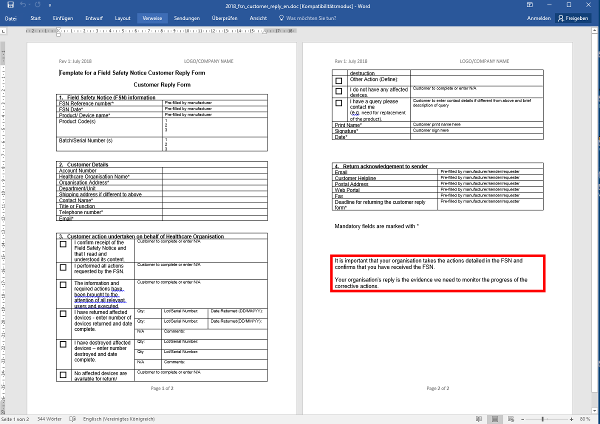
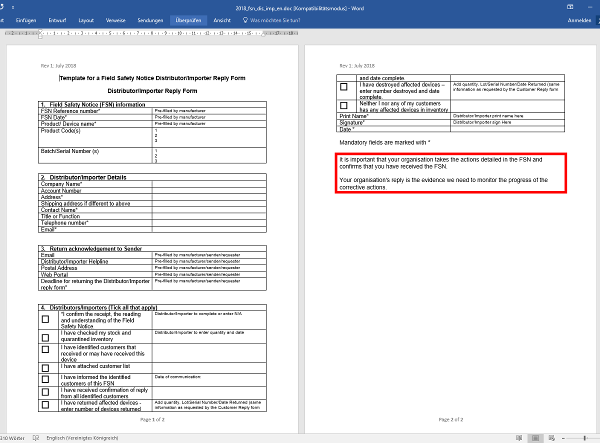
Dieses Formblatt soll zusammen mit der Sicherheitsinformation an Kunden verschickt werden, die durch Rücksendung den Erhalt und die Umsetzung der Sicherheitsinformation dokumentieren sollen.
Ähnlich wie Kunden sollen auch die Händler und Importeure den Erhalt und die Umsetzung der Sicherheitsinformation an den Hersteller bestätigen, einschließlich Informationen zu den Endkunden.
Mit den Leitlinien für produktspezifische Meldungen sollen den Herstellern Empfehlungen gegeben werden, welche Arten von Vorkommnissen im Rahmen von individuellen Meldungen, periodischen zusammenfassenden Berichten oder in Form von Trends gemeldet werden sollten. Im Zweifelsfall sollten immer Einzelmeldungen vorgenommen werden.
In dieser Arbeitshilfe finden Sie eine Einführung in die Leitlinien für produktspezifische Meldungen.
In dieser Arbeitshilfe finden Sie die Empfehlungen für die Meldung produktspezifischer Vorkommnisse für Kardiale Ablationskatheter.
In dieser Arbeitshilfe finden Sie die Empfehlungen für die Meldung produktspezifischer Vorkommnisse für koronare Stents.
In dieser Arbeitshilfe finden Sie die Empfehlungen für die Meldung produktspezifischer Vorkommnisse für Kardiale, implantierbare elektronische Produkte.
In dieser Arbeitshilfe finden Sie die Empfehlungen für die Meldung produktspezifischer Vorkommnisse für Brustimplantate.
In dieser Arbeitshilfe finden Sie eine Ausfüllhilfe und eine Zusammenstellung der Klassifizierungskodes für das neue MIR-Formblatt.
In dieser Arbeitshilfe finden Sie eine zip-Datei mit XSD und XSL-Dateien als zusätzliche Informationen für die Integration des Meldeformulars MIR mit der Vigilanz-Datenbank von Herstellern.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.12/2 rev. 2: Klinische Studien nach dem Inverkehrbringen (PMCF-Studien) vom Januar 2012.
In der Arbeitshilfe finden Sie ein Interpretatives Dokument der EU Kommission zur Implementation und den Übergangsfristen für die Richtlinie 2007/42/EG. (Hinweis: die Übergangsfristen sind ausgelaufen)
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.14/1 rev. 2: Abgrenzungs und Klassifizierungsfragen: Eine Leitlinie für Hersteller und Benannte Stellen vom Januar 2012.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.14/2 rev. 1: Produkte für Forschungszwecke vom Februar 2004.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.14/3 rev. 1: Bereitstellung von Gebrauchsanweisungen (IFU) und anderen Informationen für In-vitro Diagnostika vom Januar 2007.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.14/4: CE-Kennzeichnung von Blut-basierten In-vitro Diagnostika für die variante Creutzfeld-Jakob-Krankheit auf Basis der Erkennung abnormaler PrP Proteine vom Januar 2012.
In der Arbeitshilfe finden Sie das MEDDEV-Dokument 2.15 rev 3: Komitees/Arbeitsgruppen die zur Implementierung der Medizinprodukterichtlinien beigetragen haben vom Dezember 2008. von: Vita:
Dipl.-Phys., Dr. rer. nat., Inhaber MedDevConsult, Beratungsdienstleistungen für die Medizinprodukteindustrie, Hamburg. Weitere Beiträge: |