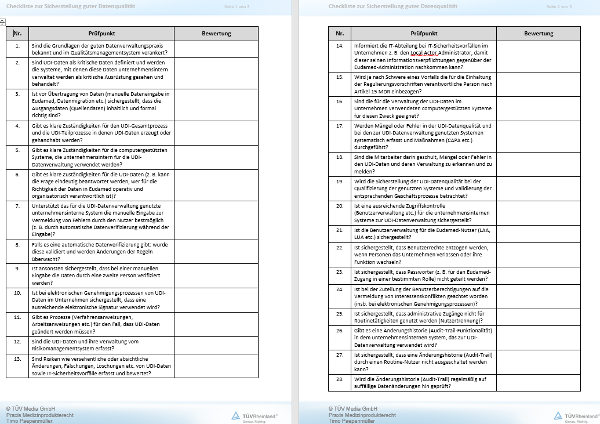
02028 Artikel 28 MDR: UDI-Datenbank
|
Artikel 28 der Verordnung (EU) 2017/745 skizziert funktionale und operative Anforderungen an ein von der EU-Kommission zu betreibendes und öffentlich zugängliches Datenbanksystem zur Erfassung und Verwaltung von UDI-Informationen (UDI-Datenbank). Die UDI-Datenbank stellt eine tragende Säule des europäischen UDI-Systems gemäß Artikel 27 dar und ist ein Baustein der europäischen Datenbank für Medizinprodukte (Eudamed). Arbeitshilfen: von: |
Artikel 28
UDI-Datenbank
(1) Nach Anhörung der Koordinierungsgruppe Medizinprodukte errichtet und betreibt die Kommission eine UDI-Datenbank, mit der die in Anhang VI Teil B genannten Angaben validiert, erfasst, verarbeitet und der Öffentlichkeit zugänglich gemacht werden.
(2) Bei der Konzeption der UDI-Datenbank trägt die Kommission den in Anhang VI Teil C Abschnitt 5 enthaltenen allgemeinen Grundsätzen Rechnung. Die UDI-Datenbank wird so konzipiert, dass keine UDI-PI und keine vertraulichen Produktinformationen geschäftlicher Art darin aufgenommen werden können.
(3) Die in die UDI-Datenbank einzugebenden zentralen Datenelemente gemäß Anhang VI Teil B werden der Öffentlichkeit kostenlos zugänglich gemacht.
(4) Bei der technischen Konzeption der UDI-Datenbank wird sichergestellt, dass die darin gespeicherten Informationen im Höchstmaß zugänglich sind, was auch einen Zugriff durch mehrere Benutzer und das automatische Hoch- und Herunterladen dieser Informationen umfasst. Die Kommission stellt den Herstellern und anderen Nutzern der UDI-Datenbank technische und administrative Unterstützung zur Verfügung.
Konsolidierte MDR-Version vom 24.04.2020 |
1 Allgemeine Anmerkungen
Ein von der Europäischen Union mit der MDR verfolgtes Ziel ist die Schaffung einer gesteigerten Markttransparenz sowie einer leichteren Verfügbarkeit von Informationen für die Öffentlichkeit und Angehörige der Gesundheitsberufe.
Diese Motivation spiegelt sich bereits in Erwägungsgrund 4
„(4) Zur Verbesserung von Gesundheit und Sicherheit sollten [...] Bestimmungen zur Gewährleistung von Transparenz und Rückverfolgbarkeit in Bezug auf Medizinprodukte eingeführt werden.”
und Erwägungsgrund 43 wider:
„(43) Transparenz und angemessener Zugang zu Informationen, die für den vorgesehenen Anwender entsprechend aufbereitet sind, sind im öffentlichen Interesse unerlässlich, um die öffentliche Gesundheit zu schützen, die Rolle der Patienten und Angehörigen der Gesundheitsberufe zu stärken und ihnen sachkundige Entscheidungen zu ermöglichen, ein solides Fundament für gesetzgeberische Entscheidungen zu schaffen und Vertrauen in das Rechtssystem aufzubauen.”
Die UDI-Datenbank als Teil von Eudamed
Um dieses Ziel erreichen zu können, stützt sich die Europäische Union auf Eudamed als das zentrale Element eines europaweiten regulatorischen Informationssystems mit einer starken öffentlichen Ausrichtung. Eudamed ist dabei als komplexes System (und nicht als einfache Datenbank) zu verstehen, dessen Funktionalität auf unterschiedlichen Komponenten oder Modulen basiert. Eine dieser Eudamed-Komponenten ist die mit Artikel 28 MDR definierte UDI-Datenbank. Entsprechend heißt es in Artikel 33 Abs. 2 MDR:
Um dieses Ziel erreichen zu können, stützt sich die Europäische Union auf Eudamed als das zentrale Element eines europaweiten regulatorischen Informationssystems mit einer starken öffentlichen Ausrichtung. Eudamed ist dabei als komplexes System (und nicht als einfache Datenbank) zu verstehen, dessen Funktionalität auf unterschiedlichen Komponenten oder Modulen basiert. Eine dieser Eudamed-Komponenten ist die mit Artikel 28 MDR definierte UDI-Datenbank. Entsprechend heißt es in Artikel 33 Abs. 2 MDR:
„(2) Folgende elektronische Systeme sind Bestandteile von Eudamed: [...]
b) die UDI-Datenbank gemäß Artikel 28 ;”
Die UDI-Datenbank wiederum bildet die Basis, um die Anforderungen des europäischen UDI-Systems im Hinblick auf die dazu erforderliche Datenverwaltung und -verfügbarkeit abbilden zu können und ist ein fester Bestandteil dieses Systems (s. Artikel 27 Absatz 1 Buchstabe d MDR).
In Artikel 28 MDR werden nun die grundlegenden Eigenschaften und Funktionalitäten dieser Datenbank definiert.
Abb. 1: Komponenten des Eudamed-Systems gemäß Artikel 33 Absatz 2 MDR
Für einen Einstieg in die Thematik ist es im Allgemeinen empfehlenswert, sich zunächst Eudamed als Gesamtsystem (Artikel 33 MDR, Artikel 34 MDR und Artikel 26 MDR) zu widmen und sich erst im Anschluss mit der UDI-Datenbank und den sonstigen Komponenten von Eudamed zu befassen. Manche konzeptionellen Zusammenhänge lassen sich so ggf. leichter nachvollziehen.
Bevor in den folgenden Abschnitten auf die Regelungen zur UDI-Datenbank näher eingegangen wird, scheint es im Vorfeld sinnvoll, einige strukturelle Zusammenhänge in Bezug auf Eudamed und die UDI-Datenbank zu erläutern.
Eudamed stellt ein komplexes Datenbanksystem dar und benötigt daher eine gewisse Struktur und Ordnung für die dort hinterlegten Daten. Dies ist nicht nur ein technisches Erfordernis, sondern darüber hinaus notwendig, um das von der EU-Kommission gesteckte Ziel von hoher Transparenz und guter Zugänglichkeit zu gewährleisten. Ein wesentlicher Aspekt dabei ist, dass Datensätze leicht über eine entsprechende Kennung gefunden und identifiziert werden können. Die UDI-Datenbank weist bereits vor ihrer verpflichtenden Nutzung aktuell über 100.000 Einträge auf, sodass eine durchdachte Struktur und Ordnung erforderlich sind, um diese Datenmengen praktisch nutzbar zu machen.
Für die UDI-Datenbank sind die maßgeblichen struktur- und ordnungsgebenden Elemente:
| • | die Basis-UDI-DI als die primäre Kennung eines Produktmodells („Produktfamilie”) gemäß Artikel 29 MDR und |
| • | die UDI-DI als primäre Kennung eines Produkts gemäß Artikel 27 MDR und Artikel 29 MDR. |
Darüber hinaus kann die einmalige Registrierungsnummer („SRN” – Single Registration Number) als die primäre Kennung der Wirtschaftsakteure „Hersteller”, „Bevollmächtigter” und „Importeur” gemäß Artikel 31 MDR ebenfalls als ein solches Element betrachtet werden.
Der Basis-UDI-DI ist die Zweckbestimmung als Ordnungsmerkmal ausdrücklich zugewiesen: „Sie [die Basis-UDI-DI] ist das wichtigste Ordnungsmerkmal für Datensätze in der UDI-Datenbank” (Anhang VI Teil C MDR).