02015 Artikel 15 MDR: Anforderungen an die für die Einhaltung der Regulierungsvorschriften verantwortliche Person (VP)
|
Mit der für die Einhaltung der Regulierungsvorschriften verantwortlichen Person (nachfolgend „Verantwortliche Person”) wird beim Hersteller bzw. beim Bevollmächtigten jeweils eine Person (oder auch mehrere, gemeinschaftlich verantwortliche Personen) gefordert, die innerhalb der Organisation dafür verantwortlich ist, dass die Regulierungsvorschriften eingehalten werden. Die Aufgaben beim Hersteller decken sich mit den als kritisch angesehenen Herstellerpflichten aus Artikel 10 MDR, die Aufgaben beim Bevollmächtigten beziehen sich auf die Pflichten des Bevollmächtigten.
Neben den Aufgaben und damit dem Verantwortungsbereich werden in Artikel 15 MDR auch die Qualifikationsanforderungen an die Verantwortliche Person beschrieben sowie Sonderregelungen für Klein- und Kleinstunternehmen und die Verpflichtung des Arbeitgebers bzw. Auftraggebers, die Verantwortliche Person wegen der korrekten Erfüllung ihrer Pflichten nicht zu benachteiligen. Arbeitshilfen: von: |
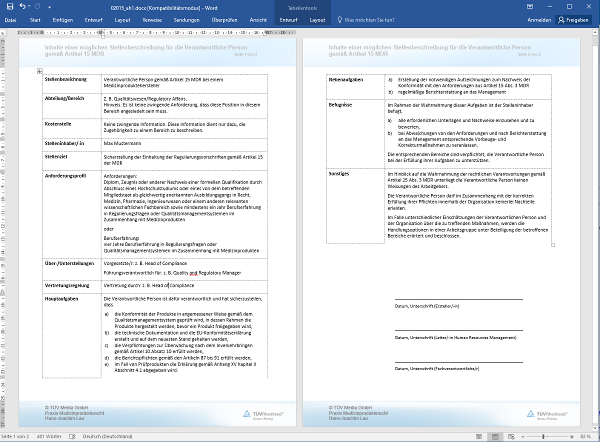
Artikel 15 MDR
Für die Einhaltung der Regulierungsvorschriften verantwortliche Person
|
1 Einleitung und Hintergrund
Basierend auf den Erwägungsgründen 34 und 35 fordert die Medizinprodukteverordnung (EU) 2017/745 (MDR) sowohl beim Hersteller als auch beim Bevollmächtigten die Benennung einer für die Einhaltung der Regulierungsvorschriften verantwortlichen Person (oder auch mehrerer verantwortlicher Personen).
„(34) Die Überwachung und Kontrolle der Herstellung von Produkten, ihre Überwachung nach dem Inverkehrbringen und die mit ihnen verbundenen Vigilanzaktivitäten sollten durch eine der Organisation des Herstellers angehörende, für die Einhaltung der Regulierungsvorschriften verantwortliche Person erfolgen, die über bestimmte Mindestqualifikationen verfügt.
(35) Für nicht in der Union niedergelassene Hersteller spielt der Bevollmächtigte eine entscheidende Rolle bei der Gewährleistung der Konformität der von den betreffenden Herstellern hergestellten Produkte und in seiner Funktion als deren in der Union niedergelassener Ansprechpartner. Angesichts dieser maßgeblichen Rolle sollte für die Zwecke der Durchsetzung der Bevollmächtigte für fehlerhafte Produkte rechtlich haftbar gemacht werden, wenn der außerhalb der Union niedergelassene Hersteller seinen allgemeinen Verpflichtungen nicht nachgekommen ist. Die Haftbarkeit des Bevollmächtigten gemäß dieser Verordnung gilt unbeschadet der Bestimmungen der Richtlinie 85/374/EWG, sodass der Bevollmächtigte zusammen mit dem Importeur und dem Hersteller als Gesamtschuldner haftbar sein sollte. Die Aufgaben des Bevollmächtigten sollten in einem schriftlichen Mandat fixiert werden. Angesichts der Rolle des Bevollmächtigten sollten die von ihm zu erfüllenden Mindestanforderungen klar definiert sein; so muss ihm unter anderem eine Person zur Verfügung stehen, die ähnliche Mindestqualifikationsanforderungen erfüllt wie die für den Hersteller tätige, für die Einhaltung der Regulierungsvorschriften verantwortliche Person.”